Pengertian Atom – Pada dasarnya, masing-masing material yang terdapat di dunia ini pasti memiliki bagian yang sangat kecil, lalu jika bagian kecil tersebut dibelah lagi, maka bakal ada bagian yang lebih kecil lagi. Nah, unsur kecil dari unsur yang terkecil itulah dinamakan dengan atom.
Dalam dunia sains, penemuan atom sekian banyak abad yang lalu dapat mengubah banyak hal. Sejarah berhubungan penelitiannya menghasilkan sekian banyak teori model-model atom dan hal yang berhubungan lainnya.
Pengertian Atom
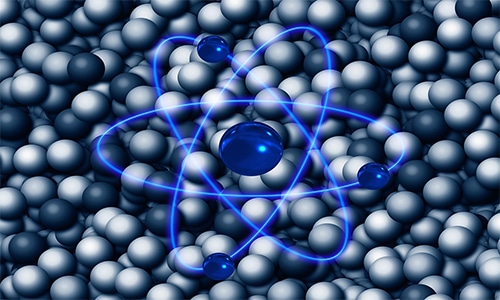
Atom merupakan unit dasar dari seluruh benda yang terdiri dari nukleus “inti atom” dan dikelilingi oleh awan elektron yang bermuatan negatif.
Inti ataom terdiri dari proton yang bermuatan positif dan neutron yang netral “kecuali pada atom hidrogen yang tidak ada neutron”.
Bagi jari-jari atom selama 3 sampai 15 nm. Elektron yang ada pada atom terbelenggu dengan inti atom oleh gaya elektromagnetik.
Yang dengan gaya tersebut pula bisa berikatan dengan atom lainnya dan menyusun sebuah molekul. Yang sampai kini, atom tidak dapat disaksikan dengan memakai alat optik manapun tergolong mikroskop. Atom yang berisi jumlah proton dan elektron yang sama mempunyai sifat netral.
Sedangkan andai jumlah proton lebih banyak, maka atomnya bermuatan positif, andai jumlah elektron lebih banyak, maka atomnya bermuatan prositif.
Dan jika jumlah elektron lebih banyak, maka atomnya bermuatan negatif. Lebih dari 99,9% massa atom berpusat pada inti atom, atom terdiri dari 3 partikel dasar yaitu:
- Proton merupakan Partikel bermuatan positif (+1), yang diameternya melulu 1/3 diameter elektron, namun mempunyai massa selama 1840 kali massa elektron.
- Elektron yaitu partikel bermuatan negatif (-1), mempunyai massa sangat ringan yaitu melulu 1/1840 kali massa proton atau neutron.
- Neutron yakni partikel tidak bermuatan “netral” mempunyai massa yang kira-kira sama dengan campuran massa proton dan elektron.
Pengertian Atom Menurut Para Ahli Fisika
1. Democritus
Dikutip dari buku Fisika Inti, Sri Jumini (2018) definisi atom menurut Bahasa Yunani yakni atomos yang memiliki makna tidak bisa dibagi.
Konsep dasar atom kesatu kali diajukan oleh Democritus pada mula abad ke-4 sebelum masehi. Berdasarkan keterangan dari teori Democritus sebuah benda dapat dipecah menjadi bagian-bagian yang paling kecil yang kesudahannya tidak dapat dipecah lagi yang dinamakan atom.
Menurut keterangan dari Democritus, atom sepenuhnya padat, tidak mempunyai struktur internal, serta terdapat ruang kosong antar atom untuk menyerahkan ruang guna pergerakannya (seperti pergerakan dalam air dan udara, atau fleksibilitas benda padat).
2. Jhon Dalton
Atom merupakan partikel terkecil daripada sebuah zat yang tidak bisa diuraikan lagi menjadi partikel yang lebih kecil melewati reaksi kimia biasa.
Di samping itu, menurut keterangan dari Dalton, atom dicerminkan sebagai bola pejal yang paling kecil, sebuah unsur mempunyai atom-atom yang identik dan bertolak belakang untuk bagian yang berbeda.
Atom-atom bergabung menyusun senyawa dengan komparasi bilangan bulat dan sederhana. Misalnya, air terdiri atom-atom hidrogen dan atom-atom oksigen.
Dan reaksi kimia adalahpemisahan atau penggabungan atau penyusunan pulang dari atom-atom, sampai-sampai atom tidak dapat dibuat atau dimusnahkan.
3. Joseph Jhon Thompson
Dalam teori atom Joseph Jhon Thompson, ialah sebuah bola yang bermuatan positif dan dikelilingi oleh elektron laksana kismis.
Secara sederhana, model atom thomson bisa analogikan sebagai jambu biji yang sudah dikelupas kulitnya. Biji jambu yang tersebar merata dimodelkan sebagai elektron dan bulatan daging jambu yang pejal dimodelkan sebagai proton.
4. Ernest Rutherford
Atom ialah partikel yang terdiri atas neutron dan proton serta dikelilingi oleh elektron. Dalam Kamus Besar Bahasa Indonesia (KBBI) atom berarti bagian kimia terkecil (setelah nuklir) yang bisa berdiri sendiri dan bisa bersenyawa dengan yang lain.
Teori Atom
Berikut ini terdapat sejumlah teori atom, yang terdiri atas:
1. Teori Atom Jonh Dalton
John Dalton menyampaikan hipotesa mengenai atom menurut hukum keabadian massa (Lavoisier) dan hukum komparasi tetap (Proust). Teori yang diusulkan Dalton.
- Atom ialah bagian terkecil dari pelajaran yang telah tidak dapat dipecah lagi.
- Atom dicerminkan sebagai bola pejal yang paling kecil, sebuah unsur mempunyai atom-atom yang identik dan bertolak belakang untuk bagian yang berbeda.
- Atom-atom bergabung menyusun senyawa dengan komparasi bilangan bulat dan sederhana. Misalnya air terdiri atom-atom hidrogen dan atom-atom oksigen
- Reaksi kimia adalah pemisahan atau penggabungan atau penyusunan pulang dari atom-atom, sampai-sampai atom tidak dapat dibuat atau dimusnahkan.
- Kelebihan dari teori Dalton ini ialah memulai minat terhadap penelitian tentang model atom.
- Kelemahannya yaitu tidak menjelaskan hubungan lautan senyawa dan daya hantar arus listrik, andai atom adalahbagian terkecil dari sebuah unsure dan tidak dapat dipecah lagi.
2. Teori Atom J.J Thomson
Setelah penemuan proton oleh Goldstein di tahun 1886 dan elektron oleh J.J. Thomson di tahun 1897. Kemudian pada tahun 1898 J.J Thomson menyampaikan model atomnya.
Model atom Thomson mengaku bahwa atom berbentuk bulat dimana muatan listrik positif yang tersebar merata dalam atom dinetralkan oleh elektron-elektron yang bermuatan negatif yang berada salah satu muatan positif.
Model atom Thomson didasarkan pada asumsi bahwa massa elektron lebih kecil dari massa atom, dan elektron adalahpartikel penyusun atom.
Karena atom bermuatan netral, maka elektron yang bermuatan negatif bakal menetralkan sebuah muatan positif dalam atom. Hal ini mendukung eksistensi proton dalam atom.
Kelebihan teori atom Thomson ini yakni membuktikan adanya partikel beda yang bermuatan negative dalam atom. Berarti atom bukan adalahbagian terkecil dari sebuah unsure.
Selain itu juga meyakinkan bahwa atom tersusun dari partikel yang bermuatan positif dan negative untuk menyusun atom netral.
Juga memperlihatkan electron ada dalam seluruh unsure. Kelemahannya ialah belum dapat menjelaskan bagaimana rangkaian muatan positif dalam bola dan jumlah electron.
3. Teori Atom Rutherford
Eksperimen yang dilaksanakan Rutherford merupakan penembakan lempeng tipis dengan partikel alpha. Ternyata partikel tersebut ada yang diteruskan, dibelokkan atau dipantulkan. Berarti di dalam atom ada susunan-susunan partikel bermuatan positif dan negatif.
Hasil riset Rutherford sekaligus menggantikan model atom Thomson, Rutherford mengajukakan model atom yang mengaku bahwa atom tersusun dari inti yang bermuatan positif dikelilingi oleh elektron-elektron yang bermuatan negatif, laksana planet mengelilingi matahari.
Massa atom terpusat pada inti dan mayoritas volum atom adalahruang hampa/kosong. Karena atom mempunyai sifat netral, maka jumlah muatan positif dalam inti (proton) mesti sama dengan jumlah elektron.
Kelebihan teori atom Ritherford ialah menyatakan bahwa atom tersusun dari inti atom dan electron yang mengelilingi inti. Kelemahannya, model itu tidak dapat menjelaskan mengapa electron tidak pernah jatuh ke inti cocok dengan teori fisika klasik.
4. Model Atom Borh
Niels Bohr dengan percobaannya menganalisa spektrum warna dari atom hidrogen yang berbentuk garis. Hipotesis Bohr ialah :
- Atom terdiri dari inti yang bermuatan positif dan dikelilingi oleh elektron yang bermuatan negatif di dalam sebuah lintasan.
- Elektron dapat beralih dari satu lintasan ke yang beda dengan menyerap atau memancarkan energi sampai-sampai energi elektron atom tersebut tidak bakal berkurang. Jika beralih lintasan ke lintasan yang lebih tinggi maka elektron bakal menyerap energi. Jika berpindah ke lintasan yang lebih rendah maka bakal memancarkan energi.
- Kelebihan atom Bohr ialah bahwa atom terdiri dari sejumlah kulit untuk lokasi berpindahnya elektron.
Kelemahan model atom ini merupakan tidak dapat menyatakan spekrum warna dari atom berelektron banyak. Sehingga dibutuhkan model atom yang lebih sempurna dari model atom Bohr.
Bentuk Atom
Atom memiliki format yang bervariasi yang dinamakan dengan Isotop, yang masing-masing format mempunyai jumlah proton dan elektron yang sama namun jumlah neutron yang berbeda.
Jadi seluruh isotop dari suatu atom mempunyai nomor ataom yang sama namum nomor massa yang berbeda. Isotop-isotop mempunyai sifat-sifat yang sama, tetapi sifat kimia yang berbeda. Sebagian besar atom dalam suatu unsur adalahsatu jenis unsur.
Partikel Dasar Atom
Seperti yang telah dilafalkan di atas, atom sebetulnya dikelilingi oleh proton yang ebrmuatan positif, neutron yang bermuatan netral, dan electron yang bermuatan negative.
Adanya partikel dasar ini tidak terlepas dari pengaruh gaya elektromagnetik yang mengikat partikel-pertikel ini. Pengertian dari setiap partikel dasar sebuah atom ialah :
1. Proton
Proton yaitu partikel dasar yang mempunyai muatan positif (+1) dan mempunyai diameter melulu 1/3 diameter electron. Akan tetapi, proton mempunyai massa selama 1840 kali electron.
2. Neutron
Neutron yakni partikel dasar yang tidak mempunyai muatan (netral), dan mempunyai massa yang sama dengan campuran antara massa proton dan massa electron.
3. Elektron
Merupakan partikel dasar yang mempunyai muatan negative (-1) dan mempunyai massa sangat ringan diantara partikel lainnya yang melulu 1/1840 kali massa proton atau neutron.
Partikel Penyusun Atom
Berikut ini terdapat sejumlah partikel penyusun atom, yang terdiri atas:
1. Partikel Subatom
Walaupun pengertian atom melafalkan bahwa atom merupakan bagian terkecil dari material yang tidak dapat dipecah lagi, dalam ilmu modern, atom sendiri tersusun atas sejumlah partikel subatom. Partikel subatom ini mencakup proton, elektron dan neutron.
2. Inti Atom
Inti atom terdiri dari proton dan neutron yang terbelenggu di inti atom oleh sebuah gaya elektromagnetik. Proton dan nutron tersebut disebut dengan nucleon (penyusun inti).
Inti atom mempunyai diameter berkisar 10-15 nm. Atom dari bagian kimia yang sama mempunyai jumlah proton yang sama pula. Suatu bagian dapat mempunyai variasi jumlah neutron yang dinamakan dengan isotop.
3. Awan Elektron
Awan partikel yakni suatu wilayah dalam sumur potensi dimana tiap-tiap electron menghasilkan sejenis gelombang diam (gelombang yang tidak bergerak).
Sifat-sifat Atom
Berikut ini terdapat sejumlah sifat-sifat atom, terdiri atas:
1. Sifat Nuklir
Sifat nuklir (radioaktif) hanya dipunyai oleh unsur-unsur atom yang mempunyai nomor atom lebih dari 82. Dari selama 339 nuklida yang telah ditemukan secar alami di bumi, sejumlah 269 diantaranya belum terpantau secara menyeluruh.
Pada bagian kima, 80 dari bagian yang diketahui mempunyai satu atau lebih isotope stabil. Unsur 43, 63, dan semu aunsur yang mempunyai nomor atom lebih dari 82 tidak mempunyai isotope stabil. Hal berikut yang mengakibatkan unsur itu mempunyai sifat radioaktif.
2. Massa Atom
Jumlah borongan dari partikel dasar dalam sebuah atom dinamakan dengan nomor massa. Massa atom dalam suasana diam dinilai dengan memakai satuan Dalton.
Massa atom dalam bagian yang bertolak belakang mempunyai massa yang bervariasi. Massa itu tergantung dari jumlah proton dan neutron dalam intinya. Semakin besar massa atom, maka semakin kecillah atom tersebut.
3. Nomor Atom
Atom-atom dalam zat yang bertolak belakang mempunyai jumlah proton yang tidak sama dalam intinya. Jumlah proton dalam inti ini dinamakan dengan nomor atom.
4. Gaya Atom
Gaya elektromagnetik mengawal elektron yang bermuatan negatif supaya tetap berada orbit sekeliling inti muatan positif.
Terdapat gaya tarik inti yang adalah gaya sangat kuat yang mengawal proton dan neutron tetap berada dalam inti atom. Gaya inti seratus kali lebih powerful daripada gaya elektromagnetik.
Demikianlah penjelasan tentang Atom dari RuangPengetahuan.Co.Id semoga bermanfaat dan menembah wawasan kalian, sampai jumpa.